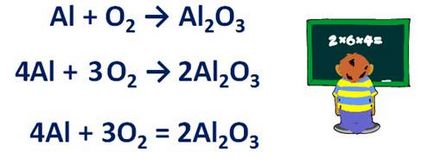химични уравнения
Урок 27. Chemistry 8 клас
Кратък обзор урок "химически уравнение"
Въз основа на закона за запазване на масата вещества представлява уравнение химически уравнение reaktsiy.Himicheskoe - запис на условен химическа реакция с химически формули и символи.
Лявата страна на уравнение е писано от формула или формула вещества, които са влезли в химична реакция. Те са наречени предшественици. между "плюс" знак от дясната страна на уравнението е написан на формулата или формулата продуктите на реакцията. т.е. вещества, които се образуват при взаимодействието между тях също поставят знака "плюс", както и между лявата и дясната страна на уравнението, поставени на стрелката.
Химическата реакция може да се представи с уравнението молекулна. Т.е. молекулна уравнение - това уравнение, в които изходните материали и реакционните продукти се записват под формата на молекули. Ако се образува утайка в реакционната смес. правото до него сложи стрелка надолу (↓), а ако се отделя газ. след това в непосредствена близост до него се примири със стрелка (↑).
След като се регистрира nahodyatkoeffitsienty схема уравнение. т.е. фигури пред формули вещества на броя на атоми преди и след реакцията са идентични.
Например, може да напише уравнението на реакцията на водород с кислород. Първоначално ние посочва формула вещества, които са влезли в химична реакция - е водород (Н2) и кислород (О2), разположен между знак "плюс", образуван от реакцията на вода - Н2 О. Между вещество лявата и дясната страна на комплекта стрелка. Нека да видим колко водородни атома от лявата и дясната страна. Два водородни атоми са получени преди и след реакцията и кислородния атом към реакцията 2, след реакция - атом. Следователно, от дясната страна на формулата, преди фактор на водата 2. Но сега дясната страна на уравнение 4 става водороден атом, и отляво само 2. За да се изравнят броя на водородните атоми, необходими за ляво-предната част на водород доставка 2. Тъй като коефициентът ние се изравни с броя на всички атоми в лявата и дясната страна на уравнението, то сега става не стрела, както и знак за равенство.
За правилния избор на коефициентите в уравнението на реакцията трябва да се извършва от няколко фактора:
Преди · формула прости вещества могат да запишат фракционна фактор. Например, в реакция на бутан изгаряне:
С4 H10 O2 → СО2 + H2O + CO2 Преди формула определен фактор 4, тъй взаимодействие на 4 въглеродни атома, съотношение вода, определен от формула 5, като взаимодействие на 10 водородни атоми. Реакцията произведени 13 кислородни атоми и до 2 реакционната атом, означава да предоставят необходимата кислород формула фактор 6,5. И тъй като коефициентът показва не само броя на атомите и молекулите, но е необходимо да се удвои съотношението в ур. Така че, уравнението ще бъде: 2C4 H10 + 13O2 → 8SO2 + 10N2 наоколо.
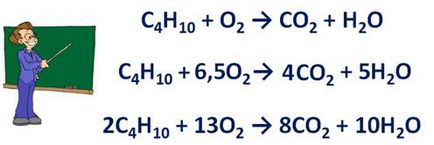
• Ако в реакционната схема е сол, първият изравняване на броя на йоните образуващи солта. Например, реакцията на фосфорна киселина и калциев хидроксид образува сол - калциев фосфат и вода.
Н 3РО 4 + Са (ОН) 2 → Са3 (РО4) 2 + Н2 О. Тази сол се състои от фосфатни йони с зареждане на 3- и калциеви йони с 2+ заплащане. Изравнете техния брой преди определяне съотношение формула 2 от фосфорна киселина и калциев хидроксид с формула - съотношение 3.
• Ако в реакционната схема има атоми на водород и кислород, първите изравнени водородните атоми и след това само кислород. От предишната схема показва, че в лявата страна на уравнение 12 водородни атома от право - 2 означава само, че преди водата да се постави формула трябва коефициент 6. Изчислява се броят на кислородните атоми. Докато реакцията на 14, след като реакцията е възможно също така, вместо 14. Следователно, стрелката равнява.
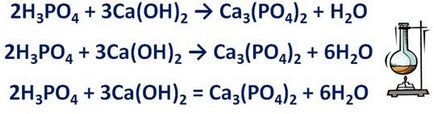
• Ако в реакционната схема, има няколко формули соли, трябва да започне изравняване с йони, съдържащи се в сол, съдържаща повече от тях. Например, в реакцията на бариев нитрат и алуминиев сулфат сол, образувана две - бариев сулфат и алуминиев нитрат. Най-голям брой йони съдържа сол - алуминиев нитрат, обаче, първо е необходимо да се изравнят йоните, които се формират от тази сол, т.е. алуминиеви йони и нитратни йони. Ва (NO3) 2 + Al2 (SO4) 3 → BaSO 4 + Al (NO3) 3. В алуминиев заряд 3+ йони от нитрат - 1-. Поради това, коефициентът настроен 3. Преди формула AL2 на (SO4) 3 трябва да предостави на коефициента 1 в лявата страна на уравнението за формула В а (NO3) 2, но това не е зададен. Изравнява останалите йони. Бариеви йони към реакционната 3 при реакцията 1, така че преди BaSO 4 формула избран съотношение 3, нитратни йони преди реакционната 6, така дясната предна Al (NO3) съотношение 3 избран 2. Броят на алуминиеви атоми към същата реакция и след, т например гости-. 2. бариеви йони и сулфатни йони преди реакцията и след реакция са еднакво - 3.
• Ако броят на атомите на елемента в една част дори уравнение схема, а другият е странно, е необходимо да се формула с нечетен брой атоми достави фактор 2 и след изравняване на броя на всички атоми. Например, за да се поставят на коефициентите в реакцията на алуминий с кислород. Al + О2 → Al2 О3. Реакцията се образува алуминиев окис - Al2 О3. Броят на кислородни атоми към реакцията дори, т.е. е две, и нечетен след реакция - 3. Следователно, преди двуалуминиев триокис от формула определен коефициент 2. Като резултат, ние се превръща 6 кислородни атоми, след реакция, означава, в лявата страна на формулата за коефициента на кислород, определени 3. Започнете да изравни броя на алуминиеви атоми и до след реакцията. Преди реакция 1 атом след реакцията - 4. Следователно, в лявата страна на формулата съотношение алуминий да създаде 4. Сега броя на атоми на всеки химичен елемент в лявата и дясната страна на уравнение е еднакво верига и стрелката трябва да се заменя със знак за равенство.